Seperti
telah dijelaskan pada postingan sebelumnya bahwa zat cair akan mendidih jika
tekanan uap jenuh zat cair tersebut sama dengan tekanan udara di sekitarnya.
Jika air murni dipanaskan pada tekanan 1 atm (760 mmHg), maka air akan mendidih
pada suhu 100 °C. Jika pada suhu yang sama dilarutkan gula, maka tekanan uap
air akan turun. Jika semakin banyak gula yang dilarutkan, maka makin banyak
penurunan tekanan uapnya. Hal ini mengakibatkan larutan gula belum mendidih
pada suhu 100 °C. Agar larutan gula cepat mendidih, diperlukan suhu yang cukup tinggi,
sehingga tekanan uap jenuhnya sama dengan tekanan uap di sekitarnya. Selisih
antara titik didih larutan dengan titik didih pelarut murni disebut kenaikan
titik didih (ΔTb).
dengan
Tb
larutan (Tb) = titik didih larutan (°C)
Tb
pelarut (Tb°) = titik didih pelarut (°C)
ΔTb = kenaikan titik didih (°C)
Perhatikan
gambar di bawah ini, pada setiap saat P selalu lebih kecil dari P°, sehingga
grafik tekanan uap larutan selalu ada di bawah pelarut dan titik didih larutan
akan lebih tinggi dari pelarut murninya.
Kenaikan
titik didih hanya tergantung pada jenis pelarut dan molaritas larutan, tidak
tergantung pada jenis zat terlarut. Untuk larutan encer, hubungan antara
kenaikan titik didih dengan molaritas larutan dinyatakan sebagai berikut.
dengan
ΔTb = kenaikan titik didih (°C)
m =
molalitas larutan (molal)
Kb =
tetapan kenaikan titik didih molal (°C/molal)
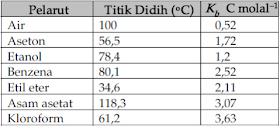
Tetapan
kenaikan titik didih molal adalah nilai kenaikan titik didih jika molaritas
larutan sebesar 1 molal. Harga Kb ini tergantung pada jenis pelarut. Harga Kb
dari beberapa pelarut diberikan pada tabel berikut ini.
Contoh Soal 1
Tentukan
kenaikan titik didih larutan gula 0,2 molal jika Kb air = 0,52 °C /molal!
Jawab:
Diketahui:
m = 0,2
molal
Kb
air = 0,52 °C /molal
Ditanyakan:
ΔTb =?
Penyelesaian:
ΔTb
= m.Kb
ΔTb
= 0,2 molal. 0,52 °C /molal
ΔTb
= = 0,104 °C
Jadi, kenaikan
titik didih larutan gula tersebut adalah 0,104 °C.
Contoh Soal 2
Suatu
zat nonelektrolit yang massanya 3,42 gram dilarutkan dalam 200 gram air.
Larutan itu mendidih pada suhu 100,026 °C. Tentukan massa molekul zat tersebut
jika Kb air = 0,52 °C/molal.
Jawab:
Diketahui:
massa
nonelektrolit = 3,42 gr
massa
air = 200 gr = 0,2 kg
Δ Tb = 100,026 °C
Kb air
= 0,52 °C/molal
Ditanyakan: Mr
nonelektrolit = ?
Penyelesaian:
ΔTb = titik didih larutan - titik didih pelarut
ΔTb = 100,026 °C - 100 °C
ΔTb = 0,026 °C
ΔTb = m.Kb
0,026
°C = m. 0,52 °C/molal
m = 0,026
°C/(0,52 °C/molal)
m =
0,05 molal
m = n/p
0,05
molal = n/0,2 kg
n =
0,05 molal.0,2 kg
n =
0,01 mol
n =
massa/Mr
Mr =
massa/n
Mr =
3,42 gr/0,01 mol
Mr =
342 gr/mol
Jadi,
massa molekul relatif zat nonelektrolit tersebut adalah 342 gr/mol.



0 Response to "Kenaikan Titik Didih Larutan Nonelektrolit"
Posting Komentar
Terima kasih sudah membaca blog ini, silahkan tinggalkan komentar dengan sopan dan tidak mengandung unsur SARA atau pornografi serta tidak ada link aktif. Mohon maaf kalau komentarnya dibalas agak lambat. Kolom komentar ini kami moderasi, jadi kalau ada komentar yang tidak sesuai dengan ketentuan tidak akan dipublikasikan.