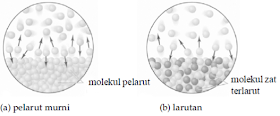
Apabila
ke dalam suatu pelarut dilarutkan zat yang tidak mudah menguap, ternyata
tekanan uap jenuh larutan menjadi lebih rendah daripada tekanan uap jenuh
pelarut murni. Dalam hal ini uap jenuh larutan dapat jenuh dianggap hanya mengandung
uap zat pelarut, seperti gambar di bawah ini.
Pernyataan
di atas tersebut juga dapat dibuktikan dengan hasil eksperimen berikut ini. Pada
suhu 28 °C air murni memiliki tekanan uap jenuh sebesar 28,36 mmHg sedangkan urea
dengan konsentrasi 0,1 M memiliki tekanan uap jenus sebesar 27,85 mmHg. Setelah
kedua zat (air dan urea) tersebut di campur konsentrasinya menjadi 0,1 M dengan
tekanan uap jenuh sebesar 27,34 mmHg.
Berdasarkan
hasil eksperimen di atas, dapat disimpulkan bahwa tekanan uap suatu larutan
akan semakin kecil, jika molaritas larutan semakin besar (bertambahnya zat
terlarut). Hal ini dikarenakan molaritas larutan yang semakin besar,
mengakibatkan fraksi mol zat terlarut juga bertambah besar.
Selisih
antara tekanan uap jenuh pelarut murni dengan tekanan uap jenuh larutan disebut
penurunan tekanan uap jenuh (ΔP).
Jika tekanan uap jenuh pelarut murni dinyatakan dengan P° dan tekanan uap jenuh
larutan dengan P, maka ΔP = P°
– P.
Francois
Raoult, seorang ahli kimia dari Perancis mendapatkan hubungan antara tekanan
uap jenuh larutan dengan tekanan jenuh pelarut dari konsentrasi larutan. Adapun
bunyi hukum Raoult yang berkaitan dengan penurunan tekanan uap adalah sebagai
berikut.
- Penurunan tekanan uap jenuh tidak bergantung pada jenis zat yang dilarutkan, tetapi tergantung pada jumlah partikel zat terlarut.
- Penurunan tekanan uap jenuh berbanding lurus dengan fraksi mol zat yang dilarutkan.
Hukum
Raoult tersebut dapat dirumuskan sebagai berikut.
Keterangan:
ΔP = penurunan tekanan uap jenuh pelarut
χB =
fraksi mol zat terlarut
P° =
tekanan uap pelarut murni
Jika
larutannya encer, nB << nA, sehingga nA + nB dapat dianggap sama dengan
nA, jadi:
Dalam
larutan terdapat zat terlarut dan pelarut, sehingga:
Jika
tekanan uap pelarut dilambangkan P, di mana P << P°, maka:
ΔP = P° – P
P° – P
= (1 – χA)P°
P° – P
= P° – χA . P°
Keterangan:
P =
tekanan uap larutan
xA =
fraksi mol pelarut
P° =
tekanan uap pelarut murni
Contoh soal 1
Manitol
sebanyak 18,04 gram dilarutkan dalam 100 gram air pada suhu 20 °C. Ternyata
tekanan uap jenuh larutan adalah 17,227 mmHg. Jika tekanan uap air jenuh pada
suhu itu 17,54 mmHg, hitunglah massa molekul manitol!
Jawab:
Diketahui:
Massa
Manitol = 18,04 gram
Massa
Air = 100 gram
P =
17,227 mmHg
P° =
17,54 mmHg
Mr Air
= 18 gr/mol
Ditanyakan:
Mr
Manitol = ?
Penyelesaian:
Kita
sekarang hitung terlebih dahulu berapa penurunan tekanan uap jenuh larutan
tersebut dengan rumus di atas, yaitu:
ΔP = P° – P
ΔP = 17,54 mmHg – 17,227 mmHg
ΔP = 0,313 mmHg
Sekarang
kita hitung besarnya jumlah mol dari air tersebut yaitu:
n.Air =
massa air/Mr.Air
n.Air =
100 gram/(18 gr/mol)
n.Air =
5,55 mol
ΔP =
P°.(nManitol/nAir)
0,313
mmHg = 17,54 mmHg.(nManitol/5,56 mol)
0,313
mmHg = 3,15 mmHg/mol.(nManitol)
n.Manitol
= 0,099 mol
Mr.Manitol
= massa Manitol/n.Manitol
Mr.Manitol
= 18,04 gram/0,099 mol
Mr.Manitol
= 182,22 gr/mol (Mr manitol yang sebenarnya 182)
Contoh Soal 2
Fraksi
mol larutan urea dalam air adalah 0,2. Tekanan uap jenuh air murni pada suhu 20
°C sebesar 17,5 mmHg. Tentukan tekanan uap jenuh larutan pada suhu tertentu!
Jawab:
Diketahui:
χ.B = 0,2
P° =
17,5 mmHg
Ditanyakan: P = ?
Penyelesaian:
ΔP =
P°.χB
ΔP =
17,5 mmHg.0,2
ΔP =
3,5 mmHg
P = P°
–ΔP
P =
17,5 – 3,5
P = 14
mmHg
Contoh Soal 3
Tentukan
penurunan tekanan uap jenuh larutan 10% massa glukosa (C6H12O6)
dalam air, jika diketahui tekanan uap air pada suhu 25 °C adalah 24 mmHg!
Jawab:
Diketahui:
massa
Glukosa= 10%
P° = 24
mmHg
Mr.Glukosa
= 180 gr/mol
Ditanyakan:
ΔP = ?
Penyelesaian:
Misal
massa larutan 100 gr maka massa glukosa yaitu:
massa
glukosa = 10% x 100 gr = 10 gr
Massa air
= massa larutan – massa glukosa
Massa
air = 100 gr – 10 gr
Massa
air = 90 gr
mol
glukosa = massa/Mr
mol
glukosa = 10 gr/(180 gr/mol)
mol
glukosa = 0,0555 mol
mol air
= massa/Mr
mol air
= 90 gr/(18 gr/mol)
mol air
= 5 mol
χ.B =
0,0555/5
χ.B =
0,0555/5
χ.B =
0,0111
ΔP = P°.χB
ΔP = 24 mmHg.0,01
ΔP = 0,24 mmHg





0 Response to "Penurunan Tekanan Uap Larutan Nonelektrolit"
Posting Komentar
Terima kasih sudah membaca blog ini, silahkan tinggalkan komentar dengan sopan dan tidak mengandung unsur SARA atau pornografi serta tidak ada link aktif. Mohon maaf kalau komentarnya dibalas agak lambat. Kolom komentar ini kami moderasi, jadi kalau ada komentar yang tidak sesuai dengan ketentuan tidak akan dipublikasikan.